از داده های ارائه شده توسط سری واکنش می توان برای پیش بینی اینکه فلز می تواند در یک واکنش جابجایی واحد ، دیگری را جابجا کند(سمنتاسیون) ، استفاده کرد. همچنین می توان از آن برای بدست آوردن اطلاعاتی در مورد واکنش فلزات در برابر آب و اسیدها استفاده کرد. نمودار سری واکنش پذیری فلزات معمولی در زیر ارائه شده است.
واکنش پذیر با آب | پتاسیم |
| سدیم | |
| لیتیم | |
| باریم | |
| استرانسیوم | |
| کلسیم | |
| مگنزیوم | |
| واکنش پذیر با اسید | آلومینیوم |
| منگنز | |
| روی | |
| کرومیوم | |
| آهن | |
| کادمیوم | |
| کبالت | |
| نیکل | |
| قلع | |
| سرب | |
| هیدروژن | |
| واکنش پذیری بسیار کم | آنتیموان |
| بیسموت | |
| مس | |
| جیوه | |
| نقره | |
| طلا | |
| پلاتین |
فلزات تمایل دارند الکترونها را به راحتی از دست داده و کاتیون تشکیل دهند. اکثر آنها با اکسیژن اتمسفر واکنش داده و اکسیدهای فلزی را تشکیل می دهند. با این حال ، فلزات مختلف واکنش های متفاوتی نسبت به اکسیژن دارند (فلزات غیرفعال مانند طلا و پلاتین هنگام قرار گرفتن در معرض هوا به راحتی اکسید تشکیل نمی دهند). در عمل سمنتاسیون فلزات گروه بالاتر باعث سمانته شدن فلزات پایینتر خود میشود. بر فرض مثال پودر روی تمامی فلزات زیر خود از کرومیوم گرفته تا پلاتین را رسوب میدهد. و از بالل به پایین واکنش پذیری فزات کمتر میشود و برای ذکر مثال آلومینیوم سریعتر از روی عمل سمنتاسیون را انجام میدهد.
خصوصیات برجسته
فلزات موجود در بالای سری واکنش ، عوامل کاهنده قدرتمندی هستند زیرا به راحتی اکسید می شوند. این فلزات خیلی راحت لکه دار و خورده می شوند.واکنش پذیری فلزات از بالا به پایین کاهش مییابد، مثبت بودن الكتريك عناصر نيز هنگام حركت به سمت پايين مجموعه واکنش فلزات ، كاهش مي يابد. تمام فلزاتی که بالاتر از هیدروژن در سری فعالیت ها قرار دارند،در واکنش با HCl رقیق یا H2SO4 رقیق ، گاز H2 آزاد می کنند.
فلزاتی که بالاتر از سری واکنش پذیری قرار می گیرند(محدوده زرد رنگ) توانایی جابجایی فلزاتی(سمنتاسیون) را دارند که از محلولهای نمکی پایین تر قرار می گیرند. فلزات با درجه بالاتر برای جداسازی از سنگ معدن و سایر ترکیبات به مقدار بیشتری انرژی نیاز دارند. ویژگی مهم دیگر این سری فعالیت ها این است که از بالا به پایین توانایی اهدای الکترون به فلزات کاهش می یابد و در واقع فلزهای محدوده زرد رنگ که در ردیفهای بالاتر هستند در سمنتاسیون موثر تر از فلز ردیف پایینتر از خود دارد.
فرم جدولی طولانی از سری واکنش پذیری
واکنش پذیری فلزات به همراه یونهای مربوطه در زیر (به ترتیب نزولی) جدول بندی شده اند.
| Reactivity Series of Metals | Ions Formed |
| Caesium | +Cs |
| Francium | +Fr |
| Rubidium | +Rb |
| Potassium | +K |
| Sodium | +Na |
| Lithium | +Li |
| Barium | 2+Ba |
| Radium | 2+Ra |
| Strontium | 2+Sr |
| Calcium | +Ca2 |
| Magnesium | Mg+ |
| Beryllium | Be2+ |
| Aluminium | Al3+ |
| Titanium | Ti4+ |
| Manganese | Mn2+ |
| Zinc | Zn2+ |
| Chromium | Cr3+ |
| Iron | Fe3+ |
| Cadmium | Cd2+ |
| Cobalt | Co2+ |
| Nickel | Ni2+ |
| Tin | Sn2+ |
| Lead | Pb2+ |
| Hydrogen | H+ (Non-Metal, Reference for Comparison) |
| Antimony | Sb3+ |
| Bismuth | Bi3+ |
| Copper | Cu2+ |
| Tungsten | W3+ |
| Mercury | Hg2+ |
| Silver | Ag+ |
| Platinum | Pt4+ |
| Gold | Au3+ |
توجه داشته باشید که فلزات موجود در محدوده قرمز با آب سرد واکنش نشان می دهند ، فلزات موجود در محدوده نارنجی نمی توانند با آب سرد واکنش دهند اما می توانند با اسیدها واکنش نشان دهند و فلزات موجود در آبی فقط با برخی از اسیدهای اکسید کننده قوی واکنش نشان می دهند.
هیدروژن علیرغم غیر فلزی بودن ، اغلب در سری واکنشها گنجانده می شود ، زیرا به مقایسه واکنش پذیری فلزات کمک می کند. فلزات قرار گرفته در بالای هیدروژن در واکنش با اسیدهای HCl و H2SO4 منجر به تولید هیدروژن میشود (از آنجا که واکنش بیشتری دارند دلیل اینکه پود روی را با این اسیدها حذف میکنیم همین فرمول زیر است).
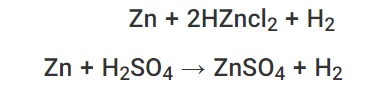
کاربردهای مهم سری واکنش
سری واکنش پذیری جدا از ارائه بینش در مورد خصوصیات و واکنش پذیری فلزات ، کاربردهای مهم دیگری نیز دارد. به عنوان مثال ، نتیجه واکنشهای بین فلزات و آب ، فلزات و اسیدها و واکنشهای جابجایی منفرد بین فلزات را می توان با کمک سری فعالیت ها پیش بینی کرد.
واکنش بین فلزات و آب
کلسیم و فلزاتی که در سری واکنش پذیری واکنش بیشتری نسبت به کلسیم دارند ، می توانند با آب سرد واکنش نشان دهند و ضمن آزاد سازی گاز هیدروژن ، هیدروکسید مربوطه را تشکیل دهند. به عنوان مثال ، واکنش بین پتاسیم و آب باعث تولید هیدروکسید پتاسیم و گاز H2 می شود ، همانطور که در معادله شیمیایی ارائه شده در زیر توضیح داده شده است.
بنابراین می توان از سری واکنش فلزات برای پیش بینی واکنش بین فلزات و آب استفاده کرد.
واکنش بین فلزات و اسیدها
سرب و فلزات بالاتر از سرب در سری فعالیتها وقتی با اسید کلریدریک یا اسید سولفوریک واکنش می دهند نمک تشکیل می دهند. این واکنش ها همچنین شامل آزادسازی گاز هیدروژن است. واکنش بین روی و اسید سولفوریک نمونه ای از چنین واکنشی است. در اینجا ، سولفات روی و گاز H2 به عنوان محصول تشکیل می شوند. معادله شیمیایی:
بنابراین ، می توان واکنش بین فلزات و برخی اسیدها را با کمک سری واکنش نشان داد
واکنشهای جابجایی منفرد بین فلزات
یونهای فلزات با درجه پایین به راحتی توسط فلزات دارای رده بالا در سری واکنش کاهش می یابند. بنابراین ، فلزات با درجه پایین به راحتی توسط فلزات با رتبه بالا در واکنشهای تغییر مکان واحد بین آنها جابجا می شوند. یک مثال عالی از چنین واکنشی ، جابجایی مس از سولفات مس توسط روی است. معادله شیمیایی این واکنش توسط:
این مفهوم چندین کاربرد عملی در استخراج فلزات دارد. به عنوان مثال ، تیتانیوم از طریق یک واکنش جابجایی با منیزیم از تتراکلرید تیتانیوم استخراج می شود. بنابراین ، از سری واکنش فلزات می توان برای پیش بینی نتیجه واکنشهای تغییر مکان منفرد نیز استفاده کرد.

با ما در ارتباط باشید.


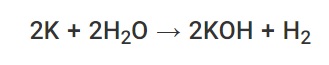
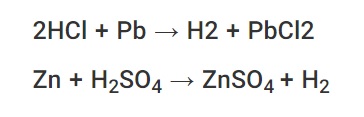
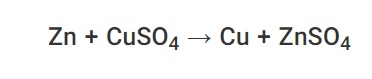
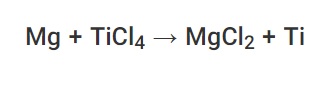



دیدگاه خود را بنویسید