ترکیبات مس (II) معمولاً آبی ، سبز و انواع رنگ در این بین هستند. برخی از ترکیبات به رنگ سبز زیتونی هستند ، اما همه ترکیبات رایج دارای رنگ هایی در محدوده آبی و سبز هستند.
با این حال ، در این آزمایش ، یک مجموعه قابل توجه با رنگ نارنجی یا قرمز روشن ساخته می شود و حتی جالب تر اینکه این مجموعه یک مجموعه مس (II) و کلرید است. برای ساختن رنگ قرمز از لیگاند خاصی استفاده نمی شود. یک کاتیون تثبیت کننده مناسب لازم است تا جداسازی این کمپلکس از محلول آبی آن فراهم شود.

تصویر بالا رنگ قرمز یا نارنجی یون پیچیده CuCl3 را نشان می دهد که به صورت نمک سزیم ، CsCuCl3 رسوب می کند.
مواد شیمیایی مورد نیاز:
- مس دی هیدرات کلرید (ترکیب بی آب نیز می توان استفاده)
- اسید کلریدریک غلیظ (30٪ یا بیشتر HCl از نظر وزنی)
- کلرید سزیم
- کلرید پتاسیم
- کلرید تترامتیل آمونیوم (اختیاری)
تجهیزات مورد نیاز:
- لوله های آزمایش
- فیلتر شیشه متخلخل
- دستمال کاغذی
ایمنی:
اسید کلریدریک غلیظ بسیار خورنده است و بخارات ناخوشایند ایجاد می کند. از تنفس بخارات خودداری کنید. اگر مقداری از اسید روی پوست ریخته شد ، سریع آب را زیر شیر آب بشویید.
آماده سازی محلول ها
یک قاشق پر از کلرید مس بردارید و آن را در یک لوله آزمایش تمیز قرار دهید. مقدار کمی اسید کلریدریک غلیظ اضافه کنید. آنقدر اضافه کنید که ماده جامد فقط حل شود. سعی کنید محلول تا حد ممکن غلیظ باشد. تصویر سمت چپ بالا در زیر کلرید مس جامد را در یک لوله آزمایش نشان می دهد. تصاویر دیگر وضعیت پس از افزودن اسید کلریدریک غلیظ (30٪) و حل شدن تمام ماده جامد را نشان می دهد. این محلول دارای رنگ سبز تیره زیتونی است، این مایع جذب شدیدی را نشان می دهد ، به طوری که حتی یک لایه نازک نیز به شیشه چسبیده و رنگ زرد / سبز شدیدی را نشان می دهد.


مقداری کلرید سزیم در لوله آزمایشگاهی ریخته و مقدار کمی آب به آن اضافه کنید. محلول حاصل نیازی به اشباع کامل ندارد ، اما باید کاملاً یک محلول غلیظ باشد. در زیر ، یک لوله آزمایش با کلرید سزیم و ترکیب آن، در آب نشان داده شده است.
تشکیل کمپلکس
ساخت کمپلکس بسیار ساده است، فقط محلول کلرید مس را به محلول کلرید سزیم اضافه کنید. وقتی این کار انجام شد ، بلافاصله رسوبی تشکیل می شود. هنگامی که کلرید سزیم اضافی باشد ، رسوب زرد بدست می آید و هنگامی که کلرید مس اضافی وجود داشته باشد ، رسوب قرمز بدست می آید.
در تصویر زیر نتیجه افزودن یک قطره بزرگ محلول کلرید مس به محلول کلرید سزیم نشان دادهشدهاست، بیشتر رسوبات به دلیل مقدار بیش از حد کلرید سزیم ، زرد رنگ است. فقط در نقاطی که غلظت زیادی کلرید مس وجود دارد رسوب قرمز است.

هنگامی که کلرید مس اضافه میشود ، در آن صورت یک ترکیب کاملاً رنگارنگ بدست می آید. هنوز از محلول کلرید مس سبز وجود دارد ، در محلول سبز رنگ قرمز و در عمیقتر رنگ زرد وجود دارد ، جایی که غلظت کلرید سزیم بیشتر است. رسوب متراکم است ، به سرعت در پایین قرار می گیرد. این رسوب لجنی نیست بلکه میکرو کریستالی است و مقدار کمی کلرید مس وجود دارد. وقتی لوله آزمایش تکان می خورد ، همه آن به نارنجی / قرمز تبدیل می شود ، مقدار اضافی کلرید مس وجود دارد.
وقتی لوله آزمایش تکان می خورد ، همه آن به نارنجی / قرمز تبدیل می شود ، مقدار اضافی کلرید مس وجود دارد.

جداسازی کمپلکس
جداسازی مجتمع در صورت استفاده از فیلتر شیشه پخته شده کار سختی نیست. مایع همراه با رسوب باید به آرامی روی فیلتر شیشه ریخته شود. مایع به سرعت توسط فیلتر جذب شده و انبوهی از جامد قرمز / نارنجی نسبتاً خشک و فشرده باقی می ماند.یک تکه دستمال کاغذی را می توان به سمت دیگر فیلتر شیشه فشار داد به طوری که تقریباً تمام مایع جذب می شود. جامد قرمز / نارنجی باقیمانده نسبتاً خالص است ، اگرچه هنوز مقداری HCl و CuCl2 خواهد داشت.
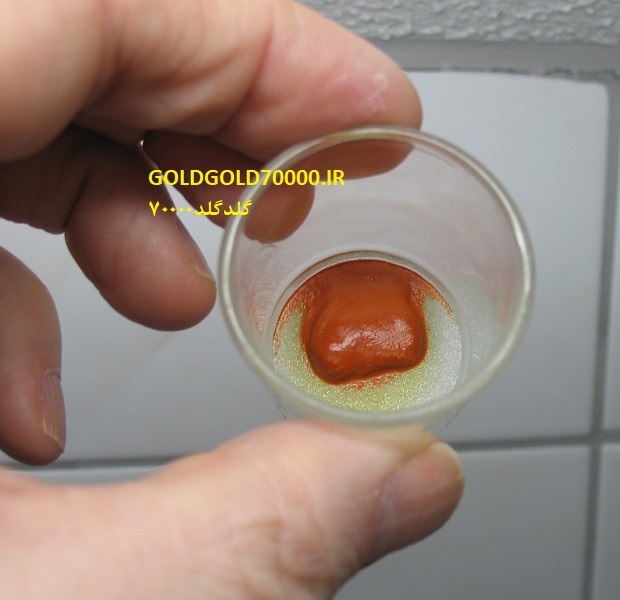
مواد را می توان در یک مکان گرم (به عنوان مثال رادیاتور حرارتی) خشک کرد. در دمای اتاق خوب خشک نمی شود. با خشک شدن مواد ، رنگ آن از قرمز به زرد تغییر می کند. تصویر زیر یک نمونه خشک شده و یک نمونه را که از مایع گرفته شده است ، نشان می دهد.

هر دو ماده خشک و مرطوب به خوبی در آب حل می شوند و یک محلول شفاف به رنگ آبی روشن می دهند.
جایگزینی کلرید سزیم با کلرید پتاسیم
این آزمایش با کلرید پتاسیم به جای کلرید سزیم تکرار شده است ، حلالیت کلرید پتاسیم در آب کمتر از کلرید سزیم است ، از این رو محلول کلرید پتاسیم برای بدست آوردن محلول با غلظت بالا تا حدودی گرم شده است (تا دمای 60 درجه سانتیگراد یا همین حدود). هنگامی که محلول کلرید پتاسیم با محلول کلرید مس در اسید کلریدریک غلیظ مخلوط شود ، نتیجه کاملا متفاوتی بدست می آید. هیچ ماده جامد زرد یا قرمز رنگی تشکیل نمیشود ،اما یک ماده جامد متبلور و سفید تشکیل شده است که به سرعت در پایین ته نشین می شود. محلول سبز تیره کلرید مس رقیق شده و تا حدودی رنگ را از سبز زیتونی به سبز چمنی تغییر می دهد.

ماده جامد به راحتی کلرید پتاسیم است. این فقط در اسید کلریدریک بسیار کم حل می شود و از محلول غلیظ رسوب می کند. به این مایع سبز با رسوب سفید مقداری کلرید سزیم جامد اضافه شد. هنگامی که این کار انجام شد ، بلافاصله رسوب قرمز تشکیل می شود و این به آرامی به رسوب سفید می خزد. به نظر می رسد که کلرید سزیم در اسید حل شده و با محلول کلرید کاپریک واکنش می دهد. دو دقیقه پس از افزودن کلرید سزیم جامد ، محتویات لوله آزمایش به شرح زیر است:

پس از تکان دادن ، تمام مایع قرمز / قهوه ای می شود. رنگ قرمز / قهوه ای کثیف تر است. این به دلیل مقدار زیاد کلرید مس است ، فقط مقدار کمی کلرید سزیم اضافه شده است.

رنگ رسوب نیز کم رنگ است. این را نیز می توان توضیح داد ، زیرا ماده جامد فقط تا حدی از مجموعه قرمز تشکیل شده است ، بخش قابل توجهی از آن ریز تقسیم کلرید پتاسیم است. این آزمایش همچنین با N (CH3) 4Cl که دارای کاتیون بزرگ است انجام شد. با این ترکیب ، به هیچ وجه رسوبی ایجاد نمی شود. با مخلوط شدن مایعات ، مایع حاصل سبز و شفاف می شود.
نتایج با دیگر فلزات از مس
این آزمایش همچنین به جای کلرید مس با کلرید کبالت و کلرید فریک انجام شد. هنگامی که محلول کلرید سزیم با محلول آبی عمیق کلرید کبالتوس در اسید کلریدریک غلیظ مخلوط می شود ، رسوب آبی مات بسیار ریز بلور تشکیل می شود.

هنگامی که محلول کلرید سزیم با محلول زرد / قهوه ای کلرید فریک در اسید کلریدریک غلیظ مخلوط می شود ، رسوب زرد / نارنجی بسیار ریز بلور تشکیل می شود. مایع بالای رسوب نیز تا حدودی رنگ را تغییر می دهد، سبک تر می شود و از زرد / قهوه ای به زرد / نارنجی تغییر می کند.

رسوب آبی و زرد / نارنجی را می توان مانند رسوب از نمک مس جدا کرد. هر دو رسوب به خوبی در آب حل می شوند. هنگامی که آب به دو لوله آزمایش اضافه می شود ، به طوری که حجم مایع تقریباً سه برابر می شود ، رسوبات کاملاً حل می شوند و در مورد کبالت ، ارتباط با کلرید نیز از بین می رود (تغییر رنگ از آبی به صورتی).

این آزمایشات نشان می دهد که سزیم همچنین دارای مجتمع های جامد با کبالت (II) و آهن (II) است.آزمایشات مشابه نیز با کلرید نیکل و کلرید کروم (III) انجام شد. اما این فلزات منجر به تشکیل کمپلکسهای جامد نمی شوند. با افزودن کلرید سزیم به محلولهای این کلریدهای فلزی در اسید کلریدریک غلیظ ، رسوبی ایجاد نمی شود.
بحث در مورد نتایج
کلرید مس هیدراته جامد نمکی کلاسیک مانند NaCl با یونهای واضح جدا شده نیست. در عوض ، بهتر می توان آن را به عنوان یک مجموعه خنثی در نظر گرفت:
CuCl2 (H2O)2
این مجموعه دارای دو یون کلرید و دو مولکول آب است که با یون مس مرکزی هماهنگ شده اند.هنگامی که کلرید کاپریک در اسید کلریدریک غلیظ حل می شود ، به دلیل غلظت بالای کلرید ، مخلوطی از کمپلکسها ایجاد می شود ، با تعادل شدید به سمت راست:
CuCl2 (H2O)2 + Cl2 → [CuCl3 (H2O)] + H2O (یون پیچیده [CuCl3 (H2O)] green سبز است)
[CuCl3(H2O)] + Cl2 ↔ [CuCl4]2 + H2O(یون پیچیده [CuCl4] 2 سبز تیره / قهوه ای است)
این محلول دارای رنگ سبز عمیق زیتونی است. وقتی آب زیادی اضافه می شود ، لیگاندهای کلرید با لیگاندهای آب جایگزین می شوند و منجر به رنگ آبی روشن یون مس آبی (II) می شوند. با افزودن یونهای سزیم ، مجموعه واکنشهای بسیار خاصی اتفاق می افتد. نمک سزیم یون کمپلکس [CuCl3 (H2O)] در اسید کلریدریک غلیظ بسیار کم حل می شود و از این رسوب می کند. در حالی که یون سزیم و یون پیچیده در یک شبکه بلوری ترکیب می شوند ، مولکول های آب از هم جدا شده و به محلول تبدیل می شوند.
Cs+ + [CuCl3 (H2O)] → Cs[CuCl3] + H2O
اگرچه فرمول ارائه شده در این معادله Cs[CuCl3]دارای ساختار پلیمری است ، بنابراین فرمول بهتری Csn[CuCl3]n با n تعداد بسیار زیاد است. این ساختار از واحدهای CuCl3 چهار ضلعی تشکیل شده است ، جایی که صورت با سه اتم Cl بر روی رئوس آن توسط دو اتم مس مشترک است. از این رو ، هر اتم مس با 6 اتم کلر در زنجیره هماهنگ می شود. بار منفی زنجیره با بار کاتیون های سزیم متعادل می شود. این جامد دارای رنگ قرمز گارنت است و وقتی ریز تقسیم شود ، نارنجی / قرمز به نظر می رسد.
در غلظت کلرید زیاد ، بیشتر مس به عنوان 2[CuCl4] وجود خواهد داشت و هنگامی که همزمان غلظت سزیم زیاد باشد ، سپس Cs2[CuCl4] زرد تشکیل می شود. این توضیح می دهد که چرا در محلول غلیظ غلیظ CsCl یک جامد زرد رسوب می کند در حالی که در محلول بیش از حد CuCl2 یک جامد قرمز رسوب می کند.
هنگامی که این جامد به آب اضافه می شود ، سپس به سرعت حل می شود ، واکنش معکوس رخ می دهد. اما در آب با غلظت کم کلرید ، واکنش بیشتر ادامه می یابد ، در نهایت منجر به از دست دادن تمام یون های کلرید و مبادله کامل با مولکول های آب می شود:
Cs [CuCl3] + H2O ↔ Cs+ + [CuCl3 (H2O)]
[CuCl3 (H2O)] + H2O ↔ CuCl2(H2O)2 + Cl
CuCl2 (H2O)2 + 2H2O ↔ CuCl (H2O)4+ +Cl
CuCl (H2O)4+ + 2H2O ↔ Cu (H2O)6+ +Cl
بنابراین ، هنگامی که ماده جامد به آب اضافه می شود ، پس از آن محلول می شود ، هنگامی که مقدار زیادی آب اضافه می شود ، یک محلول آبی کم رنگ می دهد. هنگامی که مقدار کمی آب اضافه می شود ، سپس یک محلول سبز / فیروزه ای بدست می آید.
یون سزیم در این شرایط کاملاً خاص است. K[CuCl3] از محلول اسید غلیظ رسوب نمی کند (در عوض KCl رسوب می کند) و [N(CH3)4] [CuCl3] نیز از محلول غلیظ رسوب نمی کند (به هیچ وجه رسوبی تشکیل نمی شود). طبق ادبیات ، K [CuCl3] قابل تهیه است ، اما این کار دشوارتر است و نیاز به تبخیر دقیق محلول رقیق KCl و CuCl2 بر روی یک ماده خشک کننده قوی دارد.
اطلاعات مربوط به رنگ و ساختار کمپلکس Csn[CuCl3]n از کتاب "عناصر شیمیایی و ترکیبات آنها" ، جلد 1 ، صفحه 162 ، نوشته شده توسط N.V. Sidgwick ، 1951 است.
تحقیقات اخیر نیز وجود یک ساختار زنجیره ای را تأیید می کند ، البته در این تحقیقات تازه به نظر می رسد این ساختار دارای سه اتم کلر است که توسط دو اتم مس مشترک است.
اطلاعات بیشتر در مورد آن را می توان در مجله شیمی معدنی ، جلد 5 ، شماره مشاهده کرد. 2 ، 1966 در مقاله ای با عنوان "تعیین مجدد ساختار بلوری CsCuCl3" ، نوشته شده توسط آلبرت دبلیو شلویتر ، رابرت ا. جاکوبسون و رابرت ای. راندل کردن






دیدگاههای بازدیدکنندگان
 شهریارخلیلبیان
شهریارخلیلبیان
1030 روز پیشسلام مطالب بسیار مفید هستند ممنون
ارسال پاسخ گلدگلد۷۰۰۰۰
گلدگلد۷۰۰۰۰
987 روز پیشممنونم از شما
ارسال پاسخ ایرج صادقی
ایرج صادقی
512 روز پیشبسیار مفید،خدا قوت،تشکر
ارسال پاسخ گلدگلد۷۰۰۰۰
گلدگلد۷۰۰۰۰
507 روز پیشممنونم از شما
ارسال پاسخ حسین عنایتی
حسین عنایتی
229 روز پیشتشکر فراوان از شما آقای مهندس
ارسال پاسخ گلدگلد۷۰۰۰۰
گلدگلد۷۰۰۰۰
104 روز پیش🌹🌹
ارسال پاسخ